بسیاری از بیماریها را میتوان با موفقیت در محیط ساده یک ظرف کشت سلولی درمان کرد، اما برای درمان موفقیتآمیز افراد واقعی، عامل دارویی باید در محیط بینهایت پیچیدهتر درون بدن ما سفر کند و دست نخورده به داخل سلولهای آسیبدیده برسد. این فرآیند که تحویل دارو نامیده می شود، یکی از مهم ترین موانع در پزشکی است.
همکاری بین آزمایشگاه ملی لارنس برکلی (آزمایشگاه برکلی) و Genentech، یکی از اعضای گروه Roche، در تلاش است تا با طراحی موثرترین نانوذرات لیپیدی (LNPs) – کیسه های کروی کوچک ساخته شده از مولکول های چربی، برخی از تنگناهای تحویل دارو را از بین ببرد. که عوامل درمانی را تا زمانی که به غشای سلولی متصل شوند و محتویات آنها را آزاد کنند، محصور می کنند. اولین دارویی برای استفاده از LNP در سال 2018 تأیید شد، اما روش تحویل با واکسنهای Pfizer و Moderna mRNA Covid به شهرت جهانی رسید.
این یک سیستم کاملاً هوشمند است، زیرا اگر فقط خود RNA را به بدن انسان برسانید، RNA توسط نوکلئازها تجزیه می شود و به دلیل اندازه و بار آن نمی تواند به راحتی از غشای سلول عبور کند، اما LNP ها آن را ایمن به سلول می رسانند.
چون وان ین، نویسنده ارشد، دانشمند ارشد در گروه علوم دارویی مولکول کوچک Genentech
LNP ها اکنون به عنوان یک سیستم تحویل واکسن برای سایر بیماری های عفونی یا واکسن های درمانی سرطان به طور گسترده مورد بررسی قرار می گیرند. دوام این کاربردهای جدید بستگی به این دارد که پوشش لیپیدی چقدر با سلول های هدف ترکیب می شود، فرمولاسیون های دارویی-LNP چقدر در انبار پایدار هستند (به طوری که ماندگاری طولانی دارند)، و چقدر در بدن پایدار هستند. (بنابراین آنها می توانند فعالیت دارویی طولانی مدت ایجاد کنند).
تمام این خواص توسط مخلوطی از مولکول های مورد استفاده برای ایجاد LNP و ساختار سه بعدی ذره کنترل می شود. تیم زیر نظر ین و همکارانش، گرگ هورا و میکال هامل، هر دو بیوفیزیکدان آزمایشگاه برکلی، چندین سال است که در حال مطالعه چگونگی تنظیم ساختار LNP ها برای خواص مورد نظر هستند.
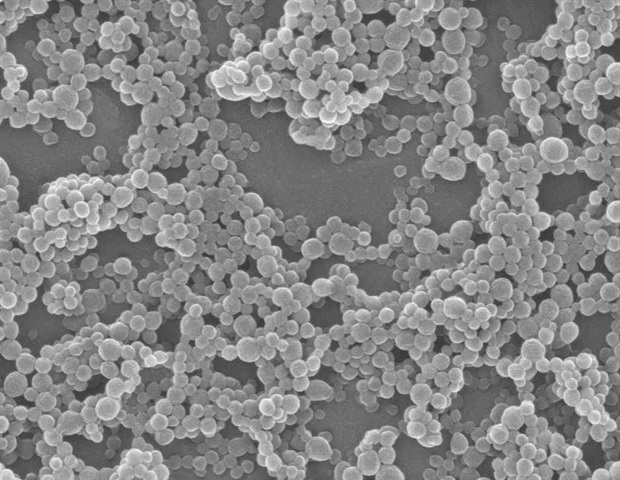
آخرین مقاله آنها که اخیراً در نانو ACS، مستند می کند که چگونه یک گردش کار با توان عملیاتی بالا به آنها اجازه می دهد تا LNP ها را با سرعت رکورد تولید و مشخص کنند. این مطالعه همچنین شامل اولین نمایش از چگونگی ارتباط ساختار LNP با فعالیت محتویات آن است، که برای این تحقیق یک الیگونوکلئوتید ضد حس (ASO) بود. ASO ها قطعه های کوچکی از جفت های RNA یا DNA هستند که با اتصال به رشته های mRNA و جلوگیری از ترجمه آنها به پروتئین، بیان ژن را مسدود می کنند. ASO ها یک راه عالی برای درمان بیماری های ناشی از پروتئین های معیوب یا فراوانی بیش از حد پروتئین هستند. اما، مانند mRNA، آنها مستعد نوکلئازهای در حال حرکت هستند – آنزیم هایی که RNA و DNA را تجزیه می کنند – و سلول ها به راحتی آنها را جذب نمی کنند.
دانشمندان کشف کردند که LNP های حامل ASO با ساختارهای داخلی منظم و بسته بندی شده در مقایسه با LNP هایی که ساختار نامنظم تری داشتند، منجر به خاموش شدن بهتر یک ژن معیوب در نورون های انسانی می شود که با یک بیماری دژنراتیو مرتبط است. این یافتهها از مطالعات مبتنی بر سلول بود، نه از مطالعات حیوانی، بنابراین هنوز کار بیشتری در پیش است، اما تیم هیجانزده است که بر اساس این بینشها با استفاده از ابزارهای مکمل هر موسسه ایجاد کند.
ین گفت: “ما LNP ها را با توان عملیاتی بالا تولید می کنیم و تیم گرگ و مایکل می توانند تجزیه و تحلیل بازده بالا را ارائه دهند.” “اگر امروز در مورد انتشار بررسی کنید، آنها معمولاً فقط یک یا دو فرمولاسیون را انجام می دهند، اما برای ما متفاوت است. ما می توانیم مجموعه داده های بزرگی تولید کنیم، و فکر می کنم به همین دلیل است که می توانیم این یافته بسیار منحصر به فرد و جالب را داشته باشیم.”
هورا، که بخشی از منطقه علوم زیستی آزمایشگاه برکلی است، افزود: “این مقاله واقعاً روشی را که ما قصد داریم برای هزاران فرمولاسیون دیگر که قصد داریم مشخص کنیم، به کار ببریم را مشخص می کند.” “ما امیدواریم که این یک روش کلی برای افراد باشد تا نانوذرات لیپیدی خود را بهینه کنند. چه واکسن باشد، و باز هم، واکسن ها تا کنون بیشترین توجه را به خود جلب کرده اند، اما این نوع درمان کاربرد بسیار گسترده ای فراتر از آن دارد.”
چگونه یک نانوذره لیپیدی بسازیم
ساختار LNP ها تحت تأثیر نحوه ترکیب آنها، آنچه با هم مخلوط می کنید و به چه ترتیبی است. LNP ها دارای چهار ماده هستند – لیپیدهای یونیزاسیون، فسفولیپیدهای کمکی، کلسترول و پلی اتیلن گلیکول-لیپیدها (PEG-lipids) – و هر عنصر دارای اشکال مختلفی است. به علاوه، آنها را می توان در نسبت های مختلف ترکیب کرد که منجر به تعداد نمایی از فرمول های ممکن می شود. مسائل پیچیده تر، LNP ها با گذشت زمان تغییر می کنند. فرمولاسیونی که به عنوان یک کره مرتب و بسته شروع می شود، در نهایت به ساختاری بی نظم تر تبدیل می شود.
دانشمندان در Genentech یک گردش کار مبتنی بر ربات ایجاد کردند که می تواند صدها فرمولاسیون LNP را تنها در چند ساعت تولید کند. سپس نمونههایی از هر فرمول به آزمایشگاه برکلی آورده میشود تا پراکندگی پرتو ایکس با زاویه کوچک (SAXS) را در منبع نور پیشرفته، یک شتابدهنده ذرات دایرهای که پرتوهای پرتو ایکس با انرژیهای مختلف ایجاد میکند، انجام دهد.
پرتو بیولوژیکی SAXS می تواند به سرعت بسیاری از نمونه ها را پردازش کند، و بر خلاف سایر اشکال پراش اشعه ایکس در مواد بیولوژیکی، نمونه ها نیازی به فریز یا کریستالیزه شدن ندارند – که می تواند ساختار LNP ها را تغییر دهد و دانشمندان را از کشف آنچه که LNP ها شبیه دمای فیزیولوژیکی بدن انسان هستند. SAXS همچنین به آنها اجازه میدهد تا از LNPها در زمانهای مشخصی عکسهای فوری بگیرند تا طول عمر ساختاری آنها را تعیین کنند.
علاوه بر این، تیم Genentech از یک فرآیند تسریع شده برای مطالعه چگونگی تأثیر LNP ها بر بیان ژن در سلول های هدف خود استفاده می کند. با ترکیب همه این تکنیکهای سریع، کل همکاری میتواند LNPهای بالقوه را با سرعتی بیسابقه غربال کند.
ین قصد دارد به استفاده از خط پرتو SAXS برای مطالعه جزئیات کوچک ادامه دهد، مانند اینکه چگونه تغییر 1 درصدی در غلظت مواد یا استفاده از یک ماشین جدید در طول تولید می تواند بر فعالیت سلولی LNP تأثیر بگذارد، و همچنین سؤالات بزرگ، مانند اینکه آیا LNP ها در صورت وجود، رفتار متفاوتی دارند یا خیر. حمل انواع محموله های دیگر و نحوه تعامل آنها با سلول های هدف مختلف.
ین گفت: “ما می دانیم که mRNA LNP ها کار می کنند، اما هنوز یک شکاف دانش بزرگ وجود دارد.” به همین دلیل است که من احساس میکنم مقاله ما در این زمینه پیشگام است و امیدوارم بتوانیم اطلاعات و درک بیشتری را برای برنامههای آینده تولید کنیم.
سایر نویسندگانی که در این کار مشارکت داشتهاند عبارتند از: یوچن فن، آپوروا سارود، امی ای. بیرن، نانژی زانگ، پونین کو، کارتیک ناگاپودی، دنیس لئونگ، کاسپر سی هوگنراد، و تائو چن.
ALS یک مرکز کاربری دفتر علوم وزارت انرژی است. SIBYLS Beamline که در آن SAXS انجام شد تا حدی توسط دفتر تحقیقات بیولوژیکی و محیطی دفتر علوم DOE پشتیبانی می شود.
منبع:
DOE/ آزمایشگاه ملی لارنس برکلی
مرجع مجله:
هامل، ام. و همکاران (2023) همبستگی ساختار و فعالیت خاموش کردن ژن نانوذرات لیپیدی بارگذاری شده با الیگونوکلئوتید با استفاده از پراکندگی اشعه ایکس با زاویه کوچک. نانو ACS. doi.org/10.1021/acsnano.3c01186.
